★ 精选11种中国人群高发且临床意义明确的单基因遗传病
★ 包含FMR1基因CGG重复和F8基因内含子倒位等特检项目
★ 热点列表针对中国人群进行优化,进一步降低残余风险
★ 可准确定量DMD外显子及SMN1/2基因拷贝数
★ 完全覆盖目标基因蛋白编码区及可变剪切区
★ 优化生信分析流程,避免同源基因干扰
出生缺陷是影响新生儿及儿童健康的重要因素之一。《中国出生缺陷防控报告》数据显示,我国出生缺陷总发生率约为5.6%【1】,其中约22%的出生缺陷由单基因遗传病导致。单基因遗传病患儿胚胎发育期多数不表现出结构畸形,影像学检查不易发现,并且许多隐性遗传病往往没有明确的家族遗传史,因此常规产检手段无法实现对单基因遗传病的有效防控。自1995年ACOG指南发布以来,多个指南及研究【2-10】指出孕妇可通过携带者筛查降低生育单基因遗传病患儿的风险,临床实践也证明单基因遗传病携带者筛查是出生缺陷防控中的有效措施。
单基因遗传病概述
单基因遗传病是指由单个基因变异引起的疾病,代表性疾病的包括:地中海贫血、苯丙酮尿症、脊髓性肌萎缩症(SMA)等。人类基因变异是普遍现象,平均每个正常人携带2.8个单基因遗传病的致病突变【3】,全球分子机制明确的单基因病超过6,000种,在人群中的综合发病率达1/100【11】,累积发病率超过唐氏综合征,其中大部分遵循隐性遗传模式,即当继承自父母的两条同源染色体、或继承自母亲的X染色体存在致病变异时发病,如图所示:
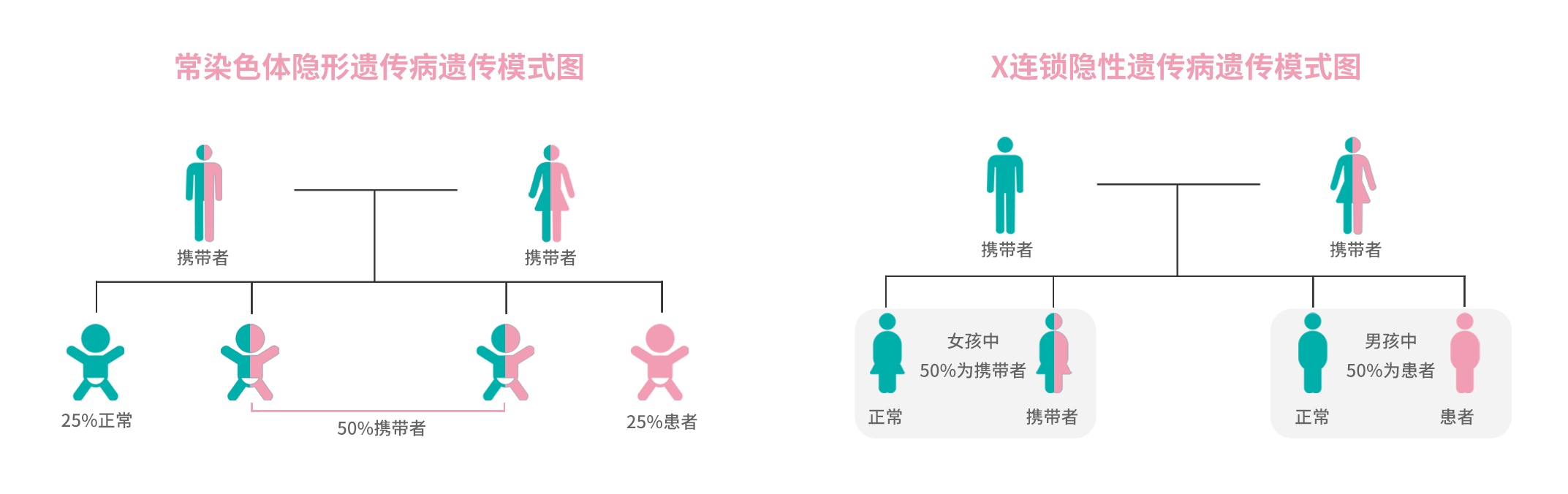
单基因遗传病携带者指个体仅携带一个致病等位基因,即只有遗传自父亲或者母亲一方的基因存在致病变异,通常不会发病,也没有明确表型提示其为携带者。80%的隐性遗传病患者没有任何家族史,所以极其容易被忽视,但缺陷基因有50%的几率遗传给下一代。
如果夫妇均表型正常,但为同一单基因遗传病携带者,则下一代同时遗传父母缺陷基因成为患儿的概率为25%,遗传父母一方缺陷基因成为携带者概率为50%。另外,当母亲为X连锁隐形遗传病携带者时,男孩发病概率为50%,女孩成为携带者的概率也同样为50%。
单基因遗传病的危害及出生缺陷防控
约2%的家庭有生育隐性遗传病患儿高风险【5】。单基因遗传病对患者的生命健康造成极大威胁,多数会致死、致畸或致残,仅5%左右的单基因遗传病存在有效治疗手段或治疗药物【12】,通常只能采取对症治疗和康复治疗,给家庭和社会带来沉重的负担。
近些年,隐性遗传病的防控实践证明,孕前或早孕期筛查和遗传咨询可以大大降低重症遗传病的发生【8,9】。随着高通量测序技术的发展,让没有家族遗传病史的普通人群也能进行快速、准确、经济的携带者筛查成为可能,同时检测多种单基因遗传病的扩展性携带者筛查 (Expanded Carrier Screening) 技术应运而生并得到快速发展及应用。
赛雷纳11种单基因遗传病携带者筛查
赛雷纳正式发布11种单基因遗传病携带者筛查产品,涵盖中国人群主要单基因遗传病种。通过深度优化的扩增子测序技术,可实现真假基因拷贝数、大片段缺失/重复、倒位等复杂变异类型的检测,进一步降低残余风险,助力出生缺陷防控。
01
疾病列表

02
产品特色
★ 精选11种中国人群高发且临床意义明确的单基因遗传病
★ 包含FMR1基因CGG重复和F8基因内含子倒位等特检项目
★ 热点列表针对中国人群进行优化,进一步降低残余风险
★ 可准确定量DMD外显子及SMN1/2基因拷贝数
★ 完全覆盖目标基因蛋白编码区及可变剪切区
★ 优化生信分析流程,避免同源基因干扰
03
适用人群
适用人群:孕早期(<14周)或有生育计划的健康夫妻(表型正常且无家族史)
慎用人群:存在家族遗传史、近亲结婚、本次妊娠胎儿超声结构异常等情况的家庭
04
检测流程
遗传咨询——知情同意——样本采集——实验室检测——数据分析及解读——报告发送

样本类型:2mL静脉血(EDTA采血管)
报告周期:自收到样本后15个工作日内,阳性样本额外增加两个工作日
05
诊疗流程
序贯筛查:先筛查女方,如果筛查出任一疾病携带,其配偶再进行该疾病的筛查

同步筛查:夫妇双方同步筛查(推荐)

赛雷纳以“聚焦生殖健康,降低出生缺陷”为宗旨,推出11种单基因遗传病携带者筛查产品,服务中国人群,为预防单基因遗传病引起的出生缺陷提供高效解决方案。
参考文献:
[1] 中华人民共和国卫生部. 中国出生缺陷防治报告 (2012) [R]. 中华人民共和国卫生部, 2012:3.
[2] ACOG Committee on Genetics.ACOG committee opinion. Number 298, August 2004. Prenatal and preconceptional carrier screening for genetic diseases in individuals of Eastern European Jewish descent.Obstet Gynecol 2004 Aug;104(2):425-8
[3] Bell CJ, Dinwiddie DL, Miller NA et al. Carrier testing for severe childhood recessive diseases by next-generation sequencing. Sci Transl Med. 2011 Jan 12;3(65):65ra4.
[4] Wayne W. Grody, et al. ACMG position statement on prenatal/preconception expanded carrier screening. Genet Med. (2013)15,482–483.
[5] Julio Martin, Asan, et al. Comprehensive carrier genetic test using next-generation deoxyribonucleic acid sequencing in infertile couples wishing to conceive through assisted reproductive technology. Fertility and Sterility 2015 Nov, 104(5):1286-93
[6] Janice G. Edwards, et al. Expanded Carrier Screening in Reproductive Medicine—Points to Consider. Obstet Gynecol 2015;125:653-62.
[7] Imran S. Haque, et al. Modeled Fetal Risk of Genetic Diseases Identified by Expanded Carrier Screening. JAMA. 2016;316(7):734-742.
[8] Committee Opinion No. 690: Carrier Screening in the Age of Genomic Medicine. Obstet Gynecol. 2017 Mar;129(3):e35-e40.
[9] Committee Opinion No. 691: Carrier Screening for Genetic Conditions. Obstet Gynecol. 2017 Mar;129(3):e41-e55.
[10] Stevens B, et al. Finding Middle Ground in Constructing a Clinically Useful Expanded Carrier Screening Panel. Obstet Gynecol. 2017 Aug;130(2):279-284.
[11] http://www.who.int/genomics/public/geneticdiseases/en/index2.html
[12] ORPHAN DRUG REPORT 2014
[13] Gregg AR, Aarabi M, Klugman S, et al. ACMG Professional Practice and Guidelines Committee. Screening for autosomal recessive and X-linked conditions during pregnancy and preconception: a practice resource of the American College of Medical Genetics and Genomics (ACMG). Genet Med. 2021 Jul 20.